
过去我们总是认为,灵芝多糖的抗癌作用,必须透过免疫系统来实现;而今随着科学的进步,有愈来愈多科学家发现,灵芝多糖对肿瘤也有直接的抑制作用。
台湾阳明大学许先业教授团队发表在2016年11月《ScientificReports》的报告即以乳腺癌为例,证实从灵芝(Ganodermalucidum)取得的多糖提取物,可以在免疫系统无法正常运作的情况下,抑制肿瘤生长和转移。
灵芝多糖抑制肿瘤生长与转移
研究者先将乳癌细胞4T1植入免疫功能缺陷小鼠的乳腺组织,7天后再向小鼠腹腔注射灵芝多糖提取物,每次剂量30mg/kg,每隔2天注射一次,持续28天。
结果发现,有灵芝多糖提取物保护的乳癌小鼠,其肿瘤体积和重量大约只有控制组(未给予灵芝多糖提取物)的三分之一和二分之一(图1、图2);转移到肺部的癌细胞数更是大幅减少,肺部增生的结节数量也少很多(图3)。
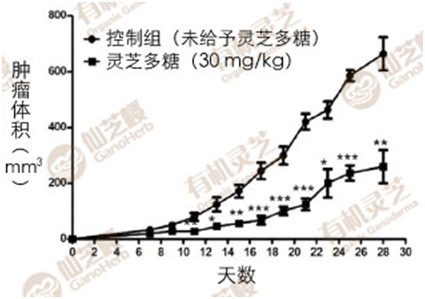
图1灵芝多糖对乳癌小鼠肿瘤生长的抑制作用(1)
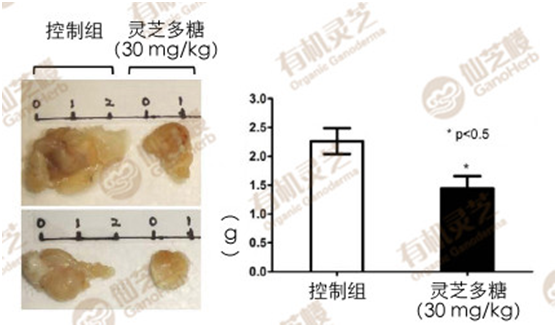
图2灵芝多糖对乳癌小鼠肿瘤生长的抑制作用(2)

图3灵芝多醣对乳癌小鼠肺部转移的抑制作用
〔说明〕图1-3的动物实验进行如下:先将乳癌细胞4T1植入免疫缺陷小鼠(BALB/c)的乳腺组织,7天后再向小鼠腹腔注射灵芝多糖提取物,每次剂量30mg/kg,每隔2天注射一次,持续28天。将小鼠解剖取其乳癌肿瘤和肺脏进行检测。(资料来源/Sci.Rep.6,36563;doi:10.1038/srep36563(2016)。)
EMT是癌细胞准备转移的#$步,灵芝多糖能加以阻止
进一步探讨灵芝多糖提取物抑制癌细胞转移的原因。从细胞实验可以观察到,灵芝多糖提取物可抑制乳癌细胞的移动,并且阻止癌细胞出现EMT现象(epithelial-mesenchymaltransition,上皮细胞间质转化)。
什么是EMT?癌细胞为了拓展领地,必须从原本的肿瘤脱离,这时它得先从排列整齐、紧密相连的癌细胞群里松脱,转变成容易移动的细胞型态,这个过程即称为EMT。
EMT现象的产生,其中一个很大的关键来自于TGF-β(转化生长因子-β)的刺激。TGF-β是动物体内调控细胞生长和发炎反应的细胞激素,许多细胞都会分泌TGF-β,包括免疫细胞和癌细胞。一旦癌细胞表面有受体可以与TGF-β相结合,就会启动EMT,使得癌细胞蠢蠢欲动。
而许先业教授团队的研究结果则显示,经灵芝多糖提取物处理的乳癌细胞,TGF-β受体的表现量会减少,癌细胞内的相关分子也受到抑制。换句话说,就像一个家的门铃坏掉了一样,即使外头有许多TGF-β,但因为癌细胞上缺乏可以被它启动的按钮,所以讯号就传不进去,也就无法诱发EMT。
灵芝多糖还能把“抗药”的乳癌细胞变得“不抗药”
此外,研究者亦针对灵芝多糖提取物与化疗药的协同作用,进行了解。实验选用两种人类乳癌细胞,一种是对赫赛汀(Trastuzumab,治疗Her2阳性乳癌的标靶药物)敏感的BT474细胞,另一种则是对赫赛汀有抗药性的SKBR3细胞。
在体外实验下,只要30μg/mL的赫赛汀就能让半数BT474细胞死亡,但在此剂量下的SKBR3细胞仍有八成活得很好,必须把剂量增加一百倍才能达到相似的杀癌效果。如果把灵芝多糖提取物与赫赛汀一起并用,则不管是敏感的BT474,或抗药的SKBR3,都能让赫赛汀的有效剂量大幅减少(图4)。
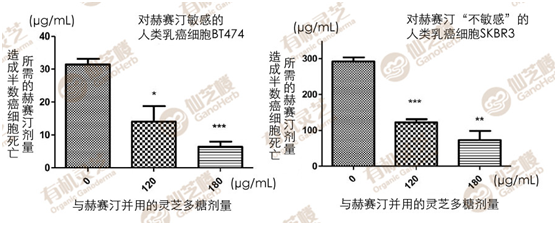
图4“灵芝多糖+标靶药赫赛汀”抑制人类乳癌细胞的协同作用
〔说明〕“赫赛汀+灵芝多糖提取物”与癌细胞一起培养72小时,造成半数癌细胞死亡所需的赫赛汀剂量(x轴)与灵芝剂量(y轴)。(资料来源/Sci.Rep.6,36563;doi:10.1038/srep36563(2016)。)
灵芝是辅助癌症治疗的好帮手
转移是导致癌症患者死亡的头号杀手,而灵芝多糖提取物可以从阻止EMT下手,从源头切断癌细胞的转移大计。虽然上述的动物实验里,肿瘤还是会长大、癌细胞还是会出现肺转移,但可别忘了,这可是在“免疫功能有缺陷”下得到的结果,如果再加上免疫系统的支援,肯定不只如此。
Her2阳性乳癌的恶性度高,当标靶药都失效时,会让治疗更加棘手,而灵芝多糖可以提高癌细胞对标靶药的敏感度,让癌细胞可以受到控制。即使是对标靶药敏感的癌细胞,也能在灵芝多糖的协助下,减少化疗药的用量,得到更好的治疗效果。
光是灵芝多糖就如此,何况是其他活性成分一起并用!当一个人正走在癌症治疗的艰困时刻,有什么理由不用灵芝?
〔资料来源〕TsaoSM,HsuHY.Fucose-containingfractionofLing-ZhienhanceslipidraftsdependentubiquitinationofTGFβreceptordegradationandattenuatesbreastcancertumorigenesis.Sci.Rep.6,36563;doi:10.1038/srep36563(2016)。
★本文原载于《灵芝新闻网》www.ganodermanews.com,获作者吴亭瑶授权刊登


